微生态制剂对畜禽免疫功能影响的研究进展
来源:恒丰强 2017-02-06 16:46:02| 查看:次 益生菌对肠上皮细胞的保护作用
肠道上皮细胞(IECs)是机体抵御病原微生物的第一道防线,是联系宿主和肠道微生物的主要桥梁,同时也是肠道免疫的基石。而益生菌可影响肠道组织的形态、代谢和功能1,在IECs感染或损伤中发挥多重保护作用。
益生菌不仅能为IECs提供重要的能源物质,其代谢产物也能促进IECs平衡。益生菌通过酵解作用产生的短链脂肪酸如乙酸、丁酸和丙酸,不仅能供能,还可改善肠道组织的局部供血,促进IECs的修复和增加胰酶的分泌量来促进肠道的生长2。ScharekL等给母猪和仔猪灌喂益生菌,发现益生菌能够增强肠道上皮细胞的功能及活性,并且对CD8+T细胞数量的增多有一定的影响3,4;而由营养不良引起的鼠肠粘膜屏障和粘膜免疫功能损伤,可以通过干酪乳酸菌的补充而恢复5;这些都说明益生菌对肠道上皮细胞有保护作用。
肠道的黏液层是肠道屏障的第一道防线,主要以黏蛋白2(MUC2)为主。益生菌可通过黏附(或无需黏附而直接作用)在肠细胞表面而诱导IECs分泌大量富含黏蛋白的黏液(特别是黏蛋白MUC2),促进黏液层的形成6,7,进而阻止致病菌在肠上皮定植。此外,益生菌可诱导表达抗菌蛋白保护黏液屏障,如α-防御素,Reg3γ等。Reg3γ只能通过微生物诱导产生,且对共生细菌和宿主上皮间的隔离空间的形成起关键作用;在受损的黏膜中Reg3γ表达的增加可调节IECs增殖8。此外,紧密连接蛋白可将肠道上皮细胞“缝合”在一起形成紧密连接,而益生菌可通过提高紧密连接蛋白的表达量增强肠道上皮的屏障功能9。此外,益生菌还可通过激活一些信号分子通路,如p38、ERK、c-Jun氨基末端激酶(JNK)和磷酸肌醇3激酶(PI3K)等,使ZO-1和Occludin蛋白磷酸化表达量增加,进而使HT-29细胞和Caco-2细胞的屏障功能增强10。
益生菌对免疫器官指数的影响
动物免疫器官重量的增加是由于其自身细胞生长发育和分裂增加所致,其重量的增加表明机体的免疫机能提高11。多项研究表明,益生菌对畜禽的免疫器官指数有促进作用。
如,Gill等将鼠李糖乳杆菌、嗜酸乳杆菌给小鼠口服后,脾细胞对丝裂原(ConA)和刀豆素(LPS)的增殖反应增强12。有学者在给1日龄肉鸡灌服益生菌后,7-18日龄的胸腺、脾脏指数、法氏囊指数均高于相应对照雏鸡13。此外有研究分析抗生素与益生菌对肉鸡免疫器官指数影响的差异,结果显示抗生素不利于免疫器官的发育,而微生态制剂则可以促进肉雏鸡免疫器官的发育,进而提高机体的免疫机能水平,有利于增强肉雏鸡的抵抗力14(见下表)。
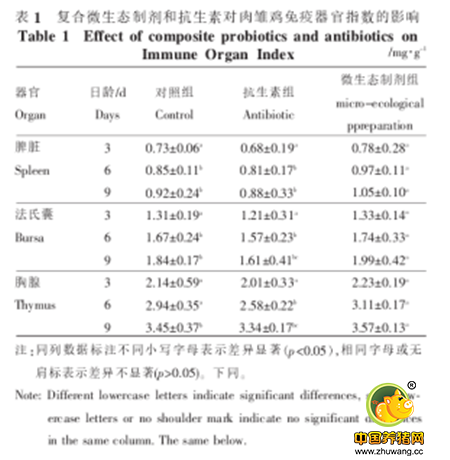
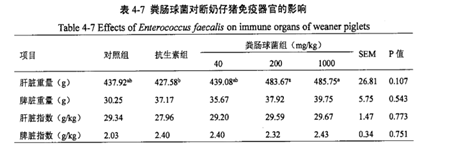
此外在猪上也有类似研究,其结果显示屎肠球菌可在一定程度上提高断奶仔猪肝脏重量和脾脏指数15(见下表)。
益生菌对免疫细胞的影响
多项研究表明,益生菌对免疫细胞有重要的调节作用。
益生菌能非特异性的促进B\T细胞的有丝分裂:如短双歧杆菌作用的靶细胞释放的活性因子直接对B细胞的分裂发挥效应;而口服分叉双歧杆菌后外周血B细胞亚群比例显著升高。此外,双歧杆菌菌体破碎后的可溶性提取物能增强巨噬细胞吞噬聚丙烯酰胺颗粒和活的沙门菌的能力,其可作为生物应答调节剂,提高NK和巨噬细胞活性等,发挥自稳调节、抗感染和抗肿瘤效应;干酪乳杆菌和保加利亚乳杆菌也被证明能激活巨噬细胞、T细胞、NK细胞的活性;而乳酸菌可活化巨噬细胞、嗜伊红白血球、肥胖细胞等免疫防御细胞增生16。此外,Yoshinori等17研究显示分枝丝状杆菌可以使小鼠小肠上皮内淋巴细胞,特别是α、β细胞以及产生IgA的细胞数增加。有学者发现枯草芽孢杆菌能提高肠上皮细胞Tcell亚群,特别是CD8+细胞的百分比;乳酸杆菌也能增加CD3+、CD4+、CD8+、和TCR2+IEL亚群的数量18。
由上可知,益生菌可促进B淋巴细胞的转化、影响T细胞,还能提高NK和巨噬细胞活性。
益生菌与肠黏膜免疫
肠粘膜免疫系统在抵抗感染方面发挥着重要作用,粘膜表面与外界抗原直接接触,是机体抗感染的第一道防线。有益菌除发挥全身免疫效应外,对局部肠粘膜也具有免疫调节作用,具体体现在以下几个方面。
1、促进IgM\IgA\IgG的分泌益生菌能显著增加免疫球蛋白A+B(IgA+B)分泌细胞的数量19。
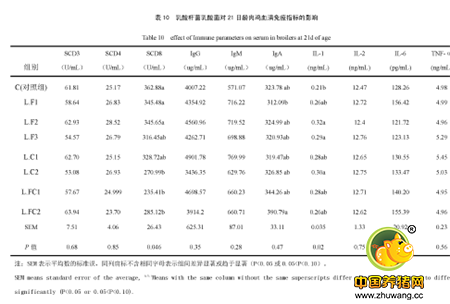
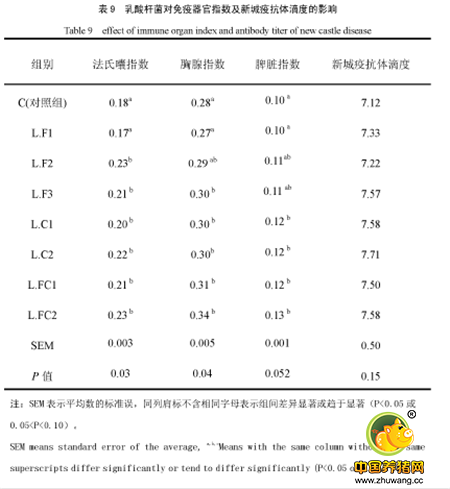
park等人在研究两歧双歧杆菌时发现,口服该菌后肠系膜淋巴结及peyer结分泌的IgA,IgM含量显著增加,同时脾、肠系膜及淋巴结的IgM\IgA\IgG分泌细胞的数量显著增多;提示口服双歧杆菌能增强粘膜和全身性的抗体响应,且益生菌本身没有特异性免疫反应,但可以通过非特异性刺激抗原的免疫反应20(见下表)。
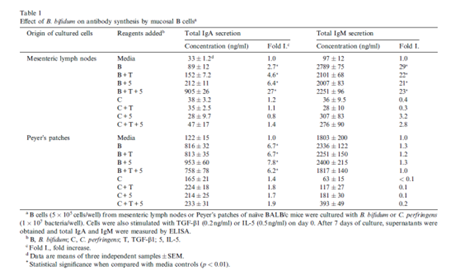
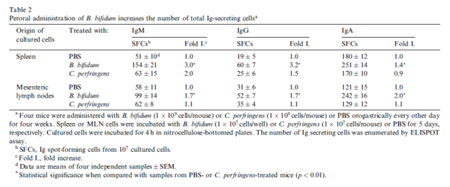
Yang等(2005)用混合益生菌(芽孢杆菌、布拉氏酵母菌和嗜酸性乳酸杆菌)灌喂蛋鸡,结果发现,灌喂组蛋鸡肠液中免疫球蛋白A(IgA)的含量显著提高,IgA、免疫球蛋白M(IgM)和免疫球蛋白G(IgG)生成细胞的数量也有显著增加趋势21。此外,乳酸杆菌被发现对肉鸡十二指肠粘膜sIgA有促进作用16(如下图)。
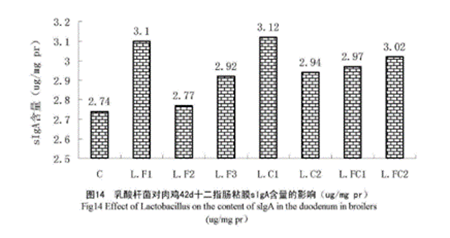
2、促进细胞因子分泌细胞因子是免疫调节肽的比较小分子量,如白细胞介素-2(IL-2)、白细胞介素-17(IL-17)、干扰素-γ(IFN-γ)及肿瘤坏死因子家族等,可参与先天和适应性免疫应答。益生菌可影响众多的细胞因子,进而影响多种免疫功能22
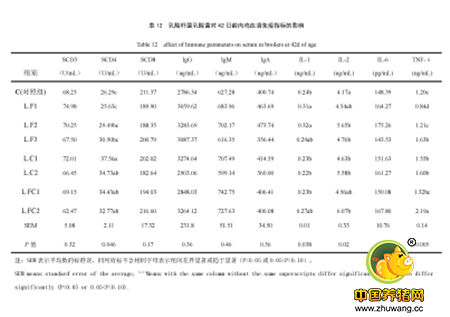
饲喂干酪乳杆菌,嗜酸乳杆菌,双歧杆菌和屎肠球菌21天后,动物表现出促炎性细胞因子IL-6表达的mRNA水平下降,而抗炎细胞因子IL-10则增加23。鼠的研究表明益生菌能增加脾肠系膜淋巴结的IL-6和TNF-α。MorenoA24等用含有益生菌的发酵乳灌胃小鼠,发现分泌TNF-a、IFN-γ和IL-2等细胞因子的细胞数量显著增加增加,肠道固有层中CD4和CD8T淋巴细胞和对照组相比也增加显著。除此之外,乳酸菌能够激活免疫细胞,增加IL-1、IL-2、IL-6、IL-5,TNF-α及TNF-γ等细胞因子的产生量,或活化B细胞产生大量免疫球蛋白IgA等抗体。如,有研究显示饲喂乳酸杆菌可以显著或趋于显著地提高肉鸡IL-1、IL-2、IL-6及TNF-α的含量,说明饲喂乳酸杆菌可以刺激淋巴细胞的生长和分化、增强活性16(见下图)。
3、分泌细菌素抗菌肽广泛分布于动植物及昆虫体内,是天然免疫(非特异性免疫)防御系统的重要组成部分。微生物来源的抗菌肽是其中主要的一种,如益生菌产生的lactobacilin XH1等25。乳杆菌可产生的抗菌肽又称为细菌素,其细菌素有20种,如plantaricin类,sakacin类,lactocin类细菌素等11。此外,双歧杆菌可诱导人肠腺上皮细胞β-防御素-2基因表达及信号转导,从而起到增强机体免疫力的作用26。防御素不仅具有免疫调节作用,还可以直接抵抗病原微生物。
益生菌与疫苗免疫反应
1、益生菌与球虫疫苗免疫
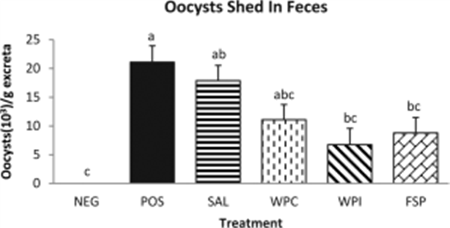
Dalloul等将肉鸡接种艾米耳球虫虫卵21天后,观察各组反应,结果显示:添加乳酸菌属益生菌的肉鸡体重最重,且粪便中虫卵数最少;同时,检测接种虫卵后不同天数的肠道IFN-γ及IL-2的变化,发现添加益生菌组的浓度显著高于对照组。说明乳酸菌属的益生菌能通过提高对抗肠道病原体的细胞免疫反应达到对肉鸡的免疫刺激作用27(见下图)。

(注:C-无益生菌的对照;A-维生素缺乏;AP-维生素A缺乏但添加益生菌;CP-只添加益生菌)
Swinkels将益生菌以饮水和拌料两种方式给予肉鸡,也观察到肉鸡接种艾米耳球虫虫卵21天后后,添加益生菌的组粪便球虫虫卵数量最少,且21、35、42天肉鸡的平均体重最大(见下图)。
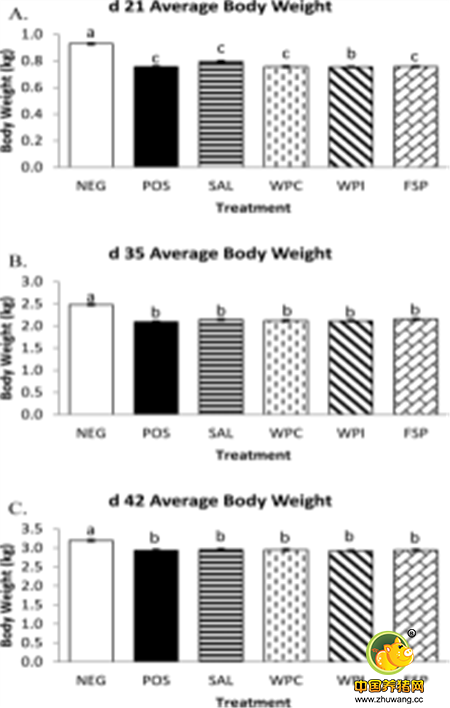
以上两个研究表明,不使用抗球虫药而只补充益生菌可以提高机体抗病力并减少艾米耳球虫对鸡的负面效应28。
2、益生菌与其他疫苗免疫
蛋鸡日粮添加枯草芽孢杆菌,30d后检测抗体,结果表明添加微生态制剂可以显著提高蛋鸡H5和H9抗体水平,且再次免疫后第18天,抗体水平与对照组相比均有提高(见下图)。
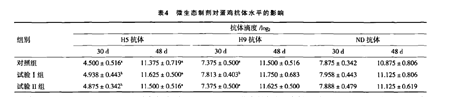
此外,有学者29给断奶仔猪饲喂乳杆菌后再接种传染性胃肠炎病毒疫苗,发现试验组血清中的特异性抗体IgG水平显著高于对照组。
由此可知,益生菌可提高机体对疫苗的特异性免疫反应30。
结论与展望
综上所述,益生菌具有保护肠道上皮细胞、增加免疫器官指数、增强肠道黏膜免疫、增强机体对疫苗的抗体应答的功能。关于益生菌的研究将对我国养殖业的可持续发展有重要意义。目前,对益生菌的研究已经不仅仅局限于单菌的研究,已经涉及到复合菌制剂的领域。当前市面上有很多益生菌制剂,但复合活菌制剂还很少,如丰强生泰(江苏恒丰强生物技术有限公司)即为四联活菌制剂。相信随着研究的进一步深入,还会有更多复合活菌制剂,为我国的畜禽业造福。
1 呙于明, 刘., 张炳坤. 家禽肠道屏障功能及其营养调控. 动物营 养学报 26, 3091-3100 (2014).
2 cukrowska B K, R. Z. H. Specificantibody and immunoglobulin responses after intestinal colonization ofgerm-free piglets with non-pathogenic escherichia coli O86. IMMUNOBIOLOGY 204, 156-169 (2001).
3 SCHAREK L, G. J., REITER K, et al.Influence of a probiotic faecium strainon development of the immune systemofsows and piglets. Veterinary Immunologyand Immunopathology 105, 151-161(2005).
4 杨金霞, 杨. 益生菌对肠道上皮细胞保护机制的研究进展. 世界华人消化杂志 4, 577-583 (2015).
5 gauffin cp, a. adjuvant effects oflactobacillus caseiadded to renutrition diet in malnourished mouse moder. biocell 26, 35-48 (2002).
6 al, K. Y. K. S. H. W. K. Y. e.Inhibition of Escherichia coli O157: H7 attachment by interactions betweenlactic acid bacteria and intestinal epithelial cells. Journal of Microbiology and Biotechnology 18, 1278 - 1285 (2008).
7 al, M. D. R. A. S. H. e. Extracellular MUC3 mucin secretion followsadherence of Lactobacillus strains to intestinal epithelial cells in vitro. Gut 52, 827 - 833 (2003).
8 Y, M. Transgenic overexpression of Reg protein caused gastric cell proliferation anddifferentiation along parietal cell and chief cell lineages. Oncogene 23, 3572 - 3579 (2004).
9 E, R. L. S. B. K. Live probiotics protect intestinalepithelial cells from the effects of infection with enteroinvasive Escherichiacoli( EIEC) Gut 52,988 - 997 (2003).
10 Resta-Lenert S, B. K. E. Liveprobiotics intestinal epithelial cells from the effects of infection withenteroinvasive Escherichia coli. Gut(2003).
11 柳洪洁, 牛. 乳杆菌与肠黏膜免疫. 中国家禽 27, 47-49 (2005).
12 Gill HS, W. D., Brandon MR ,et al In vivo inhibition by a monoclonalantibody to CD4+T cells of humoral and cellular immunity in sheep. Immunology 77, 38-42 (1992).
13 杨玉荣 , 郑., 刘 晶 ,等. 雏鸡服用益生素后免疫器官指数及局部体液免疫球蛋白相对含量的动态变化. 畜牧兽医学报 36, 352-356 (2005).
14 高林. 复合微生态制剂对肉雏鸡免疫器官指数、肠道菌群和死亡率的影响.沈阳农业大学学报 6, 747-750 (2015).
15 王永, 杨., 张桂国 饲粮中添加屎肠球菌对断奶仔猪生长性能、肠道菌群和免疫功能的影响. 动物营养学报25, 1069-1076 (2013).
16 郭元晟. 乳酸杆菌对肉鸡生产性能、免疫机能及肠道菌群的影响. (2011).
17 Umesaki Y , S. H., SatoshiMatsumoto S , et al. Differential roles of segmented filamentous bacteria andclostridia in development of the intestinal immune system. Infect Immun 67,3504-3511 (1999).
18 Dalloul R A, L. H. S., ShellemT A, et al. Enhanced mucosal immunity against Eimeria acervulina in broilersfed a Lactobacillus-based probiotic. PoultryScience 82, 62-66 (2003).
19 dogi c a, g. c. m., perdigong. gut immune stimulation by non pathogenic gram(+) and gram(-) bacteriacomparison with a probiotic strain. cytokine41, 223-231 (2008).
20 Park J H, U. J. I., Lee B J,et al. Encapsulated Bifidobacterium bifidum potentiates intestinal IgAproduction. Cellular Immunology 219, 22-27 ( 2002).
21 al, Y. Y. R. S. R. P. Z. S. M. e. Effect ofprobiotics on intestinal mucosal immunity and ultrastructure of cecal tonsilsof chickens. Archives of Animal Nutrition59 237 -246(2005).
22 Lee K W, L. S. H., Lillehoj HS, et al. Effects of direct-fed microbials on growth performance, gutmorphometry, and immune characteristics in broiler chickens. Poultry Science 89, 203-216 (2010).
23 Chichlowski M, C. W. J., EdensF W, et al. Microarchitecture and spatial relationship between bacteria andileal, cecal, and colonic epithelium in chicks fed a direct-fed microbial, PrimaLac,and salinomycin. Poultry Science 86, 1121-1132 (2007).
24 DE MORENO DE LEBLANC A, C. S.,CARMUEGA E, et al. Effect of long-term continuous consumption of fermented milkcontaining probiotic bacteria on mucosal immunity and the activity ofperitoneal acrophags. Immunobilolgy 213, 97-108 (2008).
25 杨天佑, 段., 赵瑞香,等. 嗜酸乳杆菌细菌素LactobacillinXH1的生物学特性. 食品科学 34, 197-200 ( 2013).
26 王国兴, 吴., 黄宁,等. 双歧杆菌胞壁蛋白诱导人肠腺上皮细胞β- 防御素-2基因表达及其信号转导机制.中国病理生理杂志 21, 1656-1657 (2005).
27 Dalloul R A, L. H. S., ShellemT A, et al. Intestinal Immunomodulation by Vitamin A Deficiency and Lactobacillus-BasedProbiotic in Eimeria acervulina–InfectedBroiler Chickens. Avian Diseases 47, 1313-1320 (2015).
28 Swinkels W, R. J. C. A.,Swinkels W. in Airg Conference, AvianImmunology Research Group Conference Sea World Nara Resort, 24-27(Quensland, Australia, 2008).
29 G, L. M. a. B. Effect of Lactobacillus fermentationproduct on growth, immune respond and enzyme activity in weaned pigs. Anim Sci 67, 509 (1987).
30 马春阳, 罗., 李鸿博,等微生态制剂对蛋鸡生长性能和肠道菌群及抗体效价的影响. 中国畜牧杂志 51, 60-64 ( 2015).

服务热线:400-808-6188
Copyright©2010-2022 https://www.zhuwang.cc